
O teu país
Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod

Lorem ipsum dolor sit amet, consectetur adipiscing elit, sed do eiusmod
Todos os trabalhos publicados foram gentilmente enviados por estudantes – se também quiseres contribuir para apoiar o nosso portal faz como o(a) Marcos Cachulo e envia também os teus trabalhos, resumos e apontamentos para o nosso mail: geral@notapositiva.com.
Relatório de Atividade Prático-laboratorial sobre preparação de soluções, realizado no âmbito da disciplina de Química (10º ano).
Este relatório de foi realizado no âmbito disciplinar de Física e Química A, solicitado pela professora x, após a realização de uma aula prático-laboratorial acerca da preparação de soluções.
Em, primeiro lugar convém, então, salientar que o manuseamento de reagentes implica o conhecimento das normas de segurança a respeitar, bem como as propriedades próprias do soluto, que obrigam a procedimentos particulares, nomeadamente o uso de luvas e de bata.
O soluto que se utilizou nesta atividade prático-laboratorial é um composto denominado sulfato de cobre penta-hidratado, cuja fórmula química é CuSO4.5H2O. O Sulfato de Cobre (II) ou Sulfato Cúprico é um composto químico cuja fórmula molecular é: CuSO4. Este sal existe sob algumas formas, que diferem pelo seu grau de hidratação. Deste modo, este é geralmente encontrado na sua forma penta-hidratada (CuSO4.5H2O), sendo um sólido cristalino, de cor azul-escura.
Portanto, nesta actividade laboratorial procedeu-se à diluição de uma concentração, procedimento este que consiste na adição de solvente a uma solução a fim de que se torne menos concentrada. Para isso, iniciou-se a noção de factor de diluição, ou por outras palavras, a relação entre o volume da solução diluída e o volume da solução mais concentrada de que se partiu.
Assim, tentámos aplicar os conhecimentos teóricos que adquirimos nas aulas relativos às soluções e às composições quantitativas.
A presente atividade prático-laboratorial teve como objetivos centrais a:
Material laboratorial:
Reagentes:
Dados:
CuSO4, 5H2O
V = 100 cm3= 100 ml
C = 0.020 mol/dm3
Determinação da massa molar correspondente ao sulfato de cobre penta-hidratado:MR (CuSO4.5H2O) = Ar (Cu) + Ar (S) + Ar (O) x 4 + Ar (H) 10 + Ar (O) x 5⇔
⇔ MR (CuSO4.5H2O) = 63, 55 + 32,07 + 16,00 x 4 + 1,01 10 + 16,00 x 5
⇔ MR (CuSO4.5H2O) = 63,55 + 32,07 + 64,00 + 10,10 + 80,00
⇔ MR (CuSO4.5H2O) = 249,71
M (CuSO4.5H2O) = 249,71 g/mol
Determinação da quantidade de soluto (n) na solução a preparar a partir da definição de concentração: C=n/vC= 0,02 mol/dm3
V= 50 cm3
⇔ V = 50 x 10-3 dm3
C=n/v ⇔
⇔ n = C x v
⇔ n = 0,020 x (50 10-3)
⇔ n = 0,001 mol
Cálculo da massa do soluto a partir da relação: m = n xMm = n x M ⇔
⇔ m = 0,001 x 249,71
⇔ m = 2,50 g*
*Nota:
Nesta fase do trabalho experimental foi cometido um erro acidental, relativo ao cálculo da massa do soluto. O valor real é 0,25 g, pois 0,001 x 249,71= 0,25, mas devido a este erro obteve-se 2,50 g.
Deste modo e como o erro não foi solucionado a tempo da atividade, os resultados finais serão em função do valor da massa do soluto = 2,50 g.
Dados:
Vfinal (Vf) = 50,0 ml = 50,0 cm3;
Factor de diluição = 4
Vinicial= ?
Cálculo do volume inicial (Vi):f =Vf / vi ⇔
⇔ 4 = 50 / vi
⇔ Vi = 50 / 4
⇔ Vi = 12.5 ml
Pesou-se a substância, numa Balança de precisão ± 0,01 g, a fim de se perfazer a massa de CuSO4.5H2O = 2,50 g.
Valores obtido na pesagem (g)Ensaio 1: 2,50
Ensaio 1: 2,51
Ensaio 1: 2,51
Valor médio: 2,507 ≈ 2,51
f = Ci / Cf ⇔
⇔ Cf = 0,20 / 4
⇔ Cf = 0,05 mol/dm3
Para se realizar a discussão dos resultados obtidos, é necessária a observação destes dois diagramas de fluxo, relativos a esta atividade prático-laboratorial (Figs.1 e 2).

Fig.1: Preparação de soluções por diluição rigorosa.

Fig.2: Preparação de soluções a partir de soluções anteriores.
Em primeiro lugar, no meu entender, como diluição foi feita a partir duma solução realizada anteriormente a esta, poupou-se o soluto (CuSO4.5H2O) evitando gastos desnecessários, ou seja, não foi feita uma nova solução, mas sim aproveitou-se a solução já preparada para fazer uma diluição, como consta nos objectivos desta atividade.
Através da análise das Figuras1 e 2 e tendo em conta o erro de cálculo cometido nos cálculos prévios (massa do soluto) podem ser discutidos os seguintes aspectos:
Um dos pormenores que merece o meu destaque, pois se revelou importante no decurso da atividade laboratorial, é o devido conhecimento do método de observação correcta das medições aos olhos dos operadores, isto é, a realização de uma visualização correcta (Fig.3).
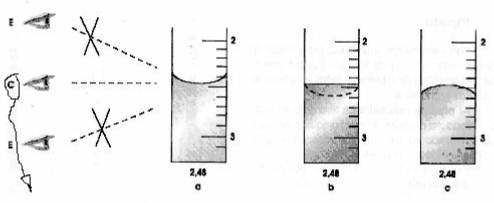
Fig.3: Esquema-síntese representativo da leitura correcta de medições aos olhos do operador.
É útil ainda referir as regras de segurança a ter com o CuSO4.5H2O (sulfato de cobre pentahidratado):
Na actividade prático-laboratorial, testámos dois tipos de soluções: concentradas e diluídas. Assim, quanto maior for a quantidade de soluto presente num dado volume de solução, maior é a sua concentração. Por isso, nas soluções mais concentradas existe maior quantidade de soluto do que nas soluções diluídas, para um mesmo volume de solução.
Nas atividades laboratoriais que foram efectuadas, o soluto utilizado foi o Sulfato de Cobre pentahidratado (CuSO4. 5H2O). Pode concluir-se, então, que a cor deste mesmo na solução inicial, era mais forte, visto ser a mais concentrada e, mais clara, na solução final, visto que sofreu um processo de diluição
Por fim, avalio positivamente o trabalho do meu grupo, ao longo deste processo, pois apesar do erro de cálculo cometido no inicio da actividade prático-laboratorial, conseguimos superar todos os desafios e objectivos propostos e adquirir, experiência laboratorial principalmente ao nível de manuseamento de materiais e ao aprofundamento do conhecimentos dos distintos métodos de preparação de soluções.